ΗΛΕΚΤΡΟΛΥΣΗ ΝΕΡΟΥ ΜΕ ΗΛΕΚΤΡΟΛΥΤΗ Na2CO3
Οι αντιδράσεις που λαμβάνουν χώρα είναι:
Na2CO3 ⟶ 2Na+ + CO3-2
Κάθοδος (-) 2H2O + 2e− ⟶ H2 + 2OH−
Άνοδος (+) 2H2O ⟶ O2 + 4H+ + 4e−
οι οποίες μας δίνουν το συνολικό μηχανισμό της ηλεκτρόλυσης
2H2O ⟶ O2 (g) + 2H2 (g)
ΗΛΕΚΤΡΟΛΥΣΗ ΝΕΡΟΥ ΜΕ ΗΛΕΚΤΡΟΛΥΤΗ NaΗCO3
Οι αντιδράσεις που λαμβάνουν χώρα είναι:
NaΗCO3 ⟶ Na+ + ΗCO3-
Κάθοδος (-) 2H2O + 2e− ⟶ H2 + 2OH−
Άνοδος (+) 2H2O ⟶ O2 + 4H+ + 4e−
Όμως, τα ιόντα H+ που παράγονται στην άνοδο αντιδρούν με τα ιόντα HCO3− και παράγεται CO2 σύμφωνα με την αντίδραση:
H+ + HCO3− ⟶ CO2 + H2O
Ο όγκος του CO2 που παράγεται στην άνοδο προστίθεται στον όγκο του Ο2. Γι΄ αυτό και δεν παρατηρείται η σωστή αναλογία όγκων υδρογόνου προς οξυγόνο που αναμένουμε στην ηλεκτρόλυση.
Ρινίσματα σιδήρου με υδροχλωρικό οξύ
Ρινίσματα σιδήρου με ένυδρο θειικό χαλκό
Αλουμινόχαρτο (αργίλιο) με ένυδρο θειικό χαλκό
Ρινίσματα ψευδαργύρου με ένυδρο θειικό χαλκό
ΠΑΙΖΟΝΤΑΣ ΜΕ ΦΛΟΥΔΕΣ ΠΟΡΤΟΚΑΛΙΟΥ/ΛΕΜΟΝΙΟΥ, ΜΠΑΛΟΝΙΑ ΚΑΙ ΚΕΡΙΑ.
ΕΦΑΡΜΟΓΗ ΣΕ ΚΕΡΙ ΡΕΣΩ
ΕΦΑΡΜΟΓΗ ΣΕ ΜΠΑΛΟΝΙΑ
Α. Θερμοχρωμικά χαρακτηρίζονται τα υλικά, οι οπτικές ιδιότητες των οποίων μεταβάλλονται με τη θερμοκρασία. Η μεταβολή αυτή μπορεί να είναι είτε βαθμιαία λόγω κάποιας διαδικασίας χημικής ισορροπίας, είτε απότομη η οποία σχετίζεται με δομική αλλαγή του υλικού. Ειδικότερα, μπορεί να αφορά τη μετάβαση από ένα χρώμα σε ένα άλλο, από τη διαφάνεια στη σκίαση ή τη διέλευση ή μη της υπέρυθρης ακτινοβολίας, χωρίς σημαντική αλλαγή της ορατής ακτινοβολίας . Επιπλέον, η μεταβολή αυτή συμβαίνει όταν η θερμοκρασία ξεπεράσει μία, χαρακτηριστική για κάθε υλικό, κρίσιμη τιμή, γνωστή και ως κρίσιμη θερμοκρασία μετάβασης (TC). Η θερμοχρωμικότητα εμφανίζεται τόσο σε ανόργανα υλικά, κυρίως οξείδια μεταβατικών μετάλλων, όσο και σε ορισμένα πολυμερή, γνωστά ως «cloud gels». Μεταξύ των οξειδίων των μεταβατικών μετάλλων NIO, FeO, CuO, CoO κ.α., ιδιαίτερη περίπτωση, όσον αφορά τη θερμοχρωμικότητα, αποτελούν τα οξείδια του Βαναδίου και δη το διοξείδιο του Βαναδίου (VO2), εξαιτίας του γεγονότος ότι η κρίσιμη θερμοκρασία μετάβασής του είναι Tc = 68 °C, η οποία είναι και η πλησιέστερη προς τη θερμοκρασία περιβάλλοντος.
Β.
Μια χρωστική ουσία leuco (από το ελληνικό λευκό leukos:λευκό) είναι μια χρωστική ουσία που μπορεί να αλλάξει μεταξύ δύο χημικών μορφών, μία από τις οποίες είναι άχρωμη. Οι αναστρέψιμοι μετασχηματισμοί μπορούν να προκληθούν από θερμότητα, φως ή αλλαγή pH, με αποτέλεσμα να συμβαίνουν φαινόμενα θερμοχρωμισμού, φωτοχρωμισμού και αλοχρωμισμού (αλλαγή χρώματος δεικτών λόγω μεταβολής pH). Η άχρωμη μορφή αναφέρεται μερικές φορές ως μορφή leuco. Οι βαφές Leuco αποτελούν τη βάση των θερμικών χαρτιών εκτυπωτή και ορισμένων δεικτών pH.

Μετασχηματισμός μεταξύ leuco και έγχρωμης μορφής κρυσταλλικής βιολετί λακτόζης, (αλοχρωμισμός).
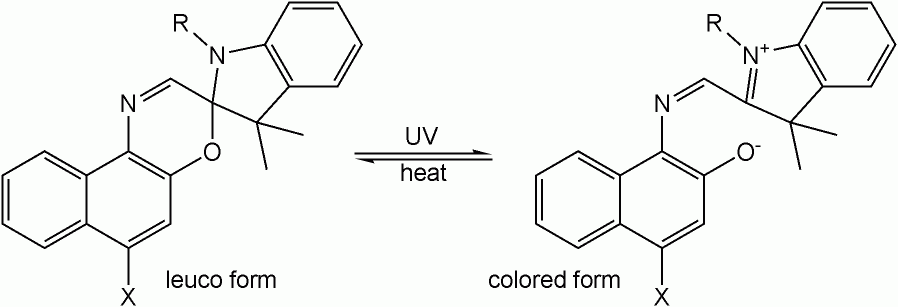
Μετασχηματισμός μεταξύ leuco και έγχρωμης μορφής που προκαλείται από υπεριώδη ακτινοβολία, (φωτοχρωμισμός).
Η χημική εξίσωση που περιγράφει την αλκοολική ζύμωση της γλυκόζης είναι η εξής:
C6H12O6 → 2 CH3CH2OH + 2 CO2 (παραγόμενη ενέργεια:118 kJ/mol)
Η διαδικασία που ακολουθούμε είναι οι εξής: Παίρνουμε μία σφαιρική φιάλη, βάζουμε μέσα τη μάγια, τη ζάχαρη και χλιαρό νερό γύρω στους 38 oC και πωματίζουμε με πώμα με τρύπα (αν υπάρχουν δύο τρύπες στο πώμα, κλείνουμε τη μία).
Μετά από ένα τέταρτο αφαιρούμε το πώμα και παίρνουμε ένα καλαμάκι από σουβλάκι (παρασχίδα). Βάζουμε φωτιά στην άκρη και παρατηρούμε ότι όταν το βάλουμε μέσα στη σφαιρική φιάλη, η φωτιά σβήνει. Όταν το βάλουμε σε σφαιρική φιάλη άδεια η φωτιά δεν σβήνει.